Hai bisogno di aiuto per scegliere il prodotto giusto?
Il nostro strumento ti aiuterà a trovare il prodotto più adatto alle tue esigenze
Accedi allo strumento di selezione dei prodottiBenvenuto sul sito Italiano
Abbiamo rilevato che potresti preferire il sito Global. Se necessario, utilizza il menu a tendina delle lingue per modificare la scelta.
La sterilizzazione è l’atto o il processo fisico o chimico che distrugge o elimina tutti i microbi vitali, comprese le spore batteriche resistenti, da un fluido o da un solido. Nonostante sia dichiarata come assoluta, l’azione di sterilizzazione è generalmente indicata in termini di probabilità di sopravvivenza di una quantità nota di un microorganismo specifico (F₀). Esistono molti metodi di sterilizzazione: chimica, calore secco, filtrazione, gas, vapore e radiazioni.
Calore umido: il vapore umido ad alta temperatura è il processo di sterilizzazione più diffuso e affidabile, dal momento che è relativamente economico, non tossico, agisce rapidamente sui microrganismi e offre una penetrazione adeguata. Per alcuni materiali può presentare aspetti negativi, come la possibilità di corrosione e il surriscaldamento.
Calore secco: usato quando il materiale potrebbe subire danni dovuti a temperature elevate o quando è impenetrabile dal vapore umido (ad es. polveri, prodotti petroliferi e strumenti taglienti). Il calore secco non è tossico, ha un costo contenuto, penetra nei materiali e non è corrosivo per i metalli e gli strumenti taglienti. La penetrazione e l’azione microbicida generalmente sono più lente rispetto all’uso del vapore. Alcune macchine sono dotate di sistemi di convezione forzata o meccanici che fanno circolare l’aria a una velocità superiore e possono ridurre i tempi di esecuzione.
La sterilizzazione con gas è soggetta a rischi di esplosione e a problemi di tossicità del gas. Di seguito sono riportati le tipologie più comuni:
Il processo è noto e il raggiungimento delle condizioni di sterilizzazione può di norma essere confermato da semplici misure fisiche.
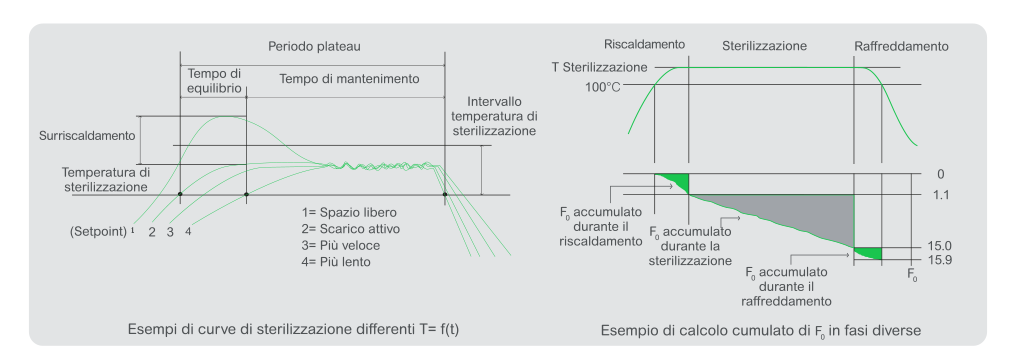
Gli sterilizzatori che utilizzano vapore ad alta temperatura per processare carichi porosi hanno una temperatura di
sterilizzazione di 134°C. Gli “sterilizzatori di fluidi” acquosi operano alla temperatura di sterilizzazione preferita di
121°C. La sterilizzazione dei fluidi si basa sulla definizione di “probabilità di un non sterile” (PNSU).
Gli sterilizzatori a secco sono essenzialmente forni elettrici. Funzionano a una temperatura di 160°C.
Per mantenere la camera leggermente al di sopra della pressione atmosferica, si utilizzano un filtro e una ventola che garantiscono che la sterilità del prodotto e l’integrità della camera bianca non siano compromesse.
I passaggi tipici sono: riscaldare, sterilizzare e raffreddare
Le nostre soluzioni soddisfano i requisiti di registrazione elettronica e firma elettronica definiti dagli enti normativi europei e statunitensi.
Il documento ufficiale è meno prescrittivo rispetto alla proposta preliminare. La versione iniziale indicava un metodo più robusto e semplice per garantire l’efficacia del ciclo di sterilizzazione attraverso la completa separazione di controllo e monitoraggio.
L’ultima versione non impedisce di combinare controllo e monitoraggio, a condizione che vengano dimostrate le “salvaguardie”. Tuttavia, l’esempio tra parentesi sembra riferirsi alla bozza preliminare che suggerisce l’uso di “sonde duplex/doppie collegate a sistemi di controllo e monitoraggio indipendenti”.
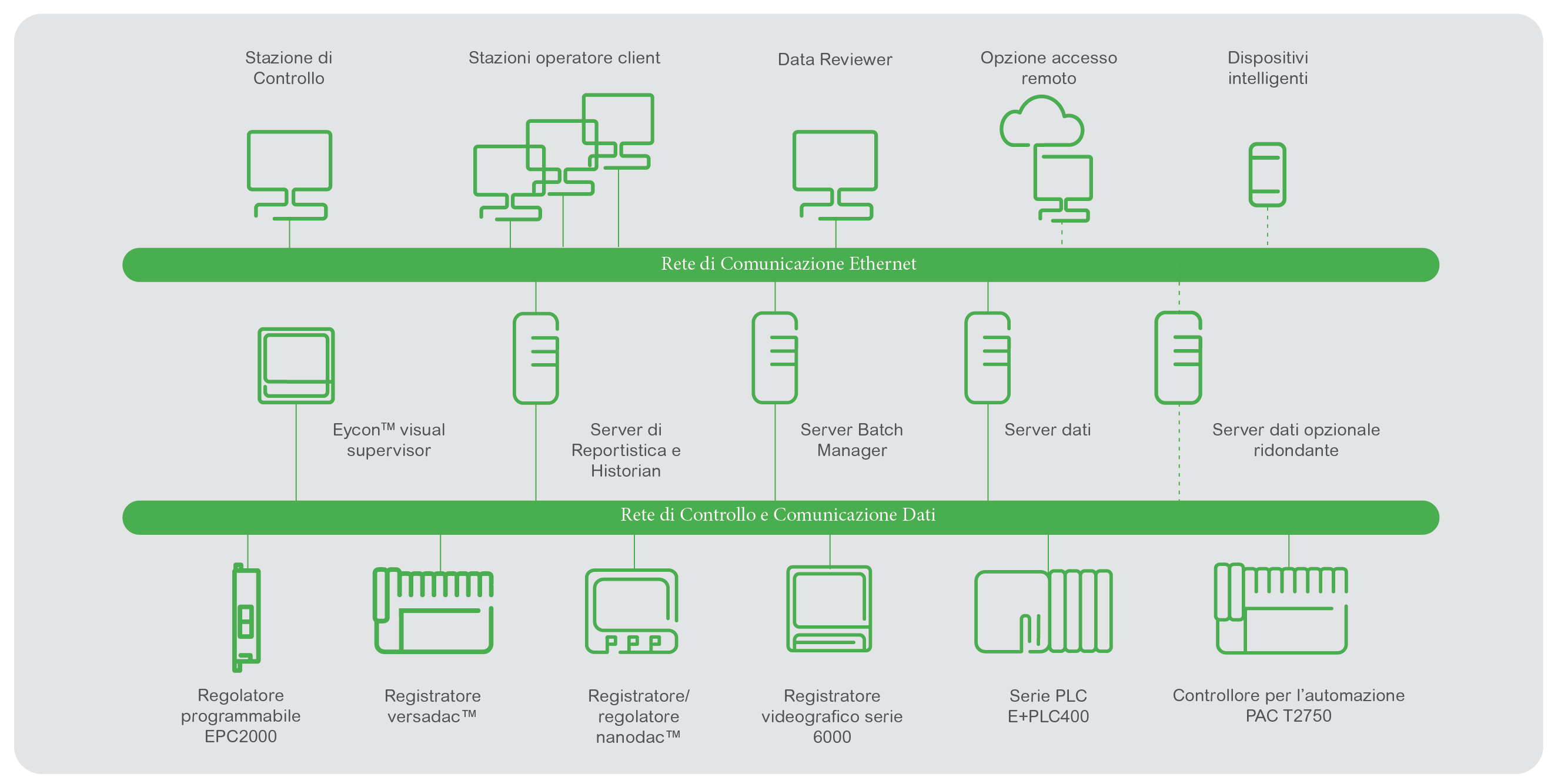
Gli esperti Eurotherm suggeriscono di mantenere separati il controllo e il monitoraggio. Questo approccio potrebbe consentire di evitare la qualifica GMP (GAMP Cat 4 o 5) per la componente di controllo, essendo questa risolta dall’elemento di monitoraggio (GAMP Cat 3). Questo metodo è simile a quello consigliato dalla guida ISPE quando suggerisce di considerare la segregazione dei sistemi di gestione degli edifici (BMS) e dei sistemi di monitoraggio ambientale (EMS).
La scelta di una soluzione di monitoraggio ridondante (ad es. PAC T2750) dotata di comunicazione seriale per il trasferimento dei dati dal monitoraggio al controllo, può ridurre la necessità di duplicare i sensori, diminuendo i costi di calibrazione e riducendo gli errori e gli allarmi.
Per prendere decisioni valide, è necessario poter considerare attendibili i dati. I principali organismi di regolamentazione (FDA, EMA, OMS) e alcuni organismi consultivi (PIC/S, ISPE) hanno concordato il concetto ALCOA+ relativo all’integrità dei dati. ALCOA+ definisce che i dati devono essere Attribuibili, Leggibili, Contemporaneamente, Originali e Accurati + Completi, Coerenti, Duraturi e Disponibili. In qualità di fornitore di soluzioni, affermato nei processi delle scienze della vita, Eurotherm è uno dei principali sostenitori di questa visione e ha contribuito alla definizione e alla revisione di alcune di queste linee guida.
Gli investimenti aziendali devono essere adatti alle sfide del futuro e gli audit non devono comportare problemi. Eurotherm ha sviluppato e ampiamente applicato una serie di documenti di qualifica delle buone prassi ingegneristiche (GEP) basati sulle linee guida ISPE GAMP 5 per contribuire al raggiungimento di tali obiettivi. I documenti di qualifica possono essere conservati in formato elettronico. L’industria sta passando dalla produzione basata su procedure operative standard (SOP) manuali a un approccio digitalizzato basato su sistemi di qualità privi di carta e sulle linee guida FDA e ICH.
In un approccio basato sulla qualità in fase di progettazione (QbD), la qualità del prodotto viene costantemente monitorata e controllata nelle prime fasi, invece di attendere il termine di un processo. I produttori farmaceutici devono concentrarsi sull’identificazione, il controllo e la convalida delle variabili di processo che potrebbero determinare un risultato non conforme. A tale scopo, è necessario gestire il profilo QTPP (Quality Target Product Profile), gli attributi di qualità critici (CQA) e i parametri di processo critici (CPP). Come definito dall’approccio PAT (Process Analytics Technology), Eurotherm può fornire assistenza nella misurazione e nell’analisi delle prestazioni dei CQA e contribuire alla gestione delle deviazioni dei CPP, fornendo prove orodatate della correlazione dei comportamenti dei parametri al loro verificarsi.
Eurotherm EMS DES adotta questa visione tramite un’architettura tecnologica flessibile in grado di fornire elaborazione dati OT (Operational Technology), audit trail contestualizzato, deviazioni di allarme, dati di processo in tempo reale e storici. Tali dati sono forniti in un formato in grado di servire piattaforme MES (Manufacturing Execution System) e servizi di analisi attraverso una serie di protocolli di comunicazione. È possibile aggiungere ulteriori misure di campo utilizzando un approccio basato su un modello e orientato agli oggetti (creazione di istanze automatiche).
Strumento di selezione dei prodotti
Il nostro strumento ti aiuterà a trovare il prodotto più adatto alle tue esigenze
Accedi allo strumento di selezione dei prodottiContattaci